Krebszellenanalyse – Ein neuer Vektor
Eine Kombination aus Laser-Innovation und durchdachter Instrumentierungs-Innovation ermöglichen ein neues Verfahren mit hohem Durchsatz zum Erlangen von potenziell wichtigen Diagnosedaten zu Brustkrebszellen.
31. Juli 2023 von Coherent

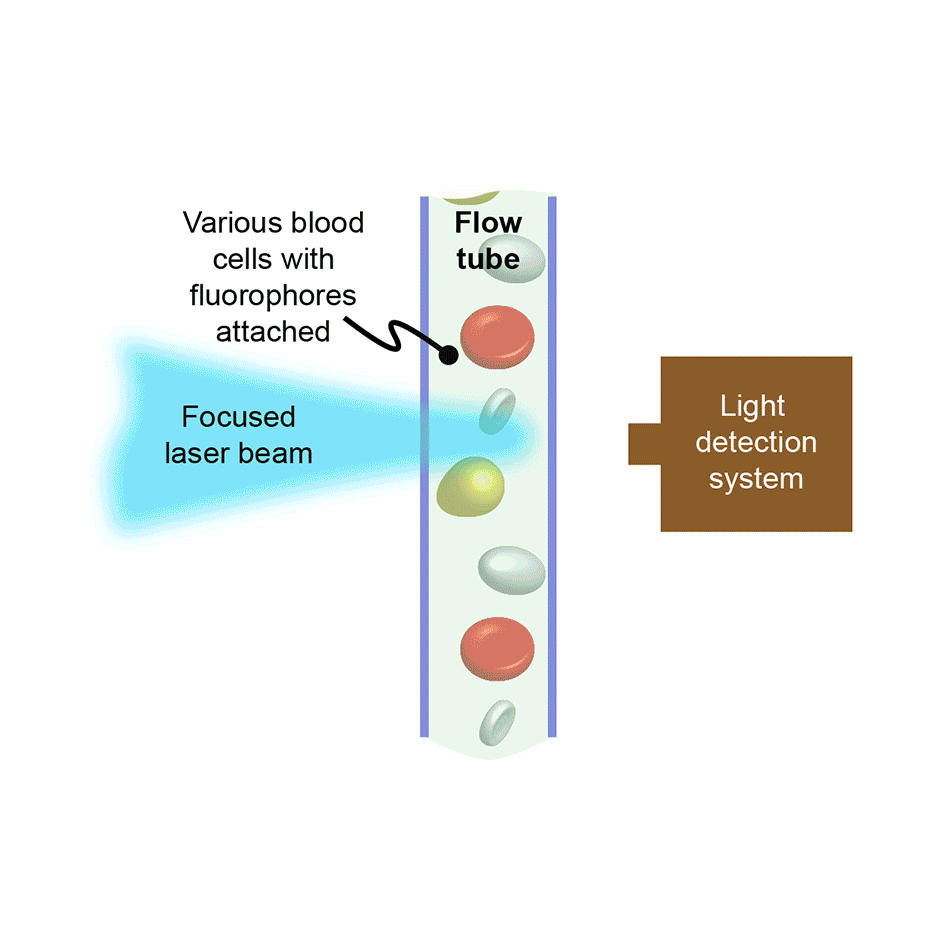
Was ist Durchflusszytometrie?
Bei der Durchflusszytometrie werden Zellen oder andere Biopartikel gezwungen, einzeln hintereinander und mit hoher Geschwindigkeit durch eine Interaktionszone zu strömen. Dort treffen sie auf einen oder mehrere fokussierte Laserstrahlen. Die resultierende, laserangeregte Fluoreszenzintensität und häufig auch die Intensität des gestreuten Laserlichts werden für jede Zelle aufgezeichnet. In Zählgeräten ermöglicht dies das schnelle Analysieren großer Zellpopulationen, um zum Beispiel festzustellen, welcher Prozentsatz der Zellen einem oder mehreren bestimmten Zelltypen angehört. In Instrumenten, die auch das Sortieren ermöglichen, werden die Zellen pro Zieltyp separat gesammelt. Sie werden dazu – wiederum basierend auf der Art von Fluoreszenz/Streuung – mithilfe eines elektrischen Felds in entsprechende Behälter gelenkt.
Die Durchflusszytometrie ist schnell und eignet sich daher für viele Anwendungsgebiete. Sie wird in der Medizin häufig zur Analyse von Blutzellen verwendet, wie etwa zum Erstellen kompletter Blutbilder. Auch wird sie in Forschungslaboren und in der Wirkstoffentwicklung eingesetzt und dabei häufig für die Analyse anderer Arten von Säugetierzellen als Blutzellen verwendet. Gelegentlich werden mit ihr winzige Organismen im Meerwasser untersucht oder auch, um Spermien für die Tierhaltung nach Geschlecht zu sortieren, damit zum Beispiel bei Milchkühen die Geburtenrate weiblicher Tiere erhöht werden kann.
Einsatz von mehr Wellenlängen und von Wellenlängen im Ultraviolettbereich
Zwar existiert die Durchflusszytometrie schon seit Jahrzehnten, doch sie ist ein recht dynamisches Feld. Ein großer Trend ist die Multiparameter-Durchflusszytometrie, bei der bis zu 12 verschiedene Laserwellenlängen verwendet werden, um eine große Anzahl unterschiedlicher Zellparameter zu analysieren. Die Laserhersteller unterstützen diesen Trend, indem sie ihre Laser mit neuen Wellenlängen in einem gemeinsamen Format anbieten und mehrere Laser in einer schlüsselfertigen Laser-Engine unterbringen. (Die OBIS-Produktreihe von Coherent steht für beide Entwicklungen.)
Ein weiterer Trend ist der zunehmende Einsatz von Laserwellenlängen im Ultraviolettbereich (UV). Dies ermöglicht, sowohl das Multiparameter-Konzept zu erweitern als auch die Autofluoreszenz zu nutzen. Dabei handelt es sich Zellmaterialien, die ohne den Einsatz von Fluoreszenzfarbstoffen oder anderen Zusatzstoffen auf natürliche Weise fluoreszieren. Zu diesen Materialien gehören einige wichtige metabolische Kofaktoren wie NAD(P)H und FAD.
Forscher nutzen die Zeit, um Dinge herauszufinden
In einer früheren Coherent-Erfolgsgeschichte haben wir beschrieben, wie die Forschungsgruppe um Professorin Jessica Houston (New Mexico State University) Pionierarbeit bei der Entwicklung und Nutzung der zeitaufgelösten Durchflusszytometrie leistet. Wir haben besprochen, warum die Gruppe sich auf NAD(P)H und FAD konzentriert: um Zellen nicht nur zu zählen, sondern auch um deren Stoffwechselzustand zu bestimmen. Dr. Houston erklärt: „Die meisten Messverfahren der Durchflusszytometrie basieren auf der Intensität der Fluoreszenzsignale. Es können jedoch bei diesem Messverfahren viele Faktoren zu Störungen und Fehlern führen. Dazu zählt auch die Menge des auf der Oberfläche oder im Inneren der Zellen gebundenen Fluorochroms. Wir beschlossen, auch die Abklingzeiten des Fluoreszenzsignals der einzelnen Zellen zu untersuchen. Die Lebensdauer ist von der Konzentration unabhängig. Sie hängt vom chemischen Zustand des Fluorochroms oder des natürlichen (endogenen) Materials ab, das die Autofluoreszenz verursacht. Endogene Fluoreszenz kann uns einzigartige Informationen über den Stoffwechselzustand von Zellen liefern. Mithilfe der Informationen können wir zum Beispiel beurteilen, ob eine Zelle normal funktioniert oder ob es sich um eine transformierte Zelle, also eine Krebszelle, handelt.“
Ihr besonderes Interesse gilt NAD(P)H und FAD, da die Fluoreszenzlebensdauer dieser Kofaktoren anzeigt, ob sie an Proteine gebunden sind oder nicht. Dies wiederum zeigt an, wie die Zelle Zucker zur Energiegewinnung oxidiert. In der Regel sind dies Prozesse, die als oxidative Phosphorylierung und als Glykolyse bezeichnet werden. Viele Krebszellen und andere defekte oder gestörte Zellen weisen hohe Werte an gemessenem freiem, also ungebundenem, NAD(P)H auf. Das deutet darauf hin, dass diese Zellen Energie durch den weniger effizienten Prozess der Glykolyse erzeugen. Das optisch gemessene Mengenverhältnis von FAD zu NAD(P)H wird als Redoxverhältnis bezeichnet. Es zeigt die Stoffwechselaktivität der Zelle an.
Ein geschicktes Verfahren mit CW-Lasern
Um zeitbezogene Daten zu erhalten, nutzte die Gruppe um Dr. Houston zunächst das Pulsen des Laserstrahls. Das Instrument zeichnet dabei das Abklingen des Fluoreszenzpulses auf zwei Arten auf. Entweder als Abklingkurven in Echtzeit, wenn die Laseranregung abgeschaltet wird, oder im Frequenzbereich, wenn der Laser wiederholt mit sehr hoher Geschwindigkeit moduliert wird. Bei letztgenannter Methode nutzte die Gruppe zur Überwachung von FAD einen OBIS-Laser mit einer Wellenlänge von 375 nm. Um jedoch das vollständige Redoxverhältnis genau zu bestimmen, müssen sowohl FAD als auch NAD(P)H gemessen werden. Und um die Abklingzeiten der NAD(P)H-Fluoreszenz unabhängig messen zu können, ist eine noch tiefer im UV-Bereich liegende Anregung erforderlich – bei etwa 349 nm.

Schlüsselkonzepte der nFLIC-Methode. Wenn die Zellen das ungleichmäßige Strahlprofil passieren, steigt und fällt die Fluoreszenz. Die Phasenverzögerung im Vergleich zum Anregungsprofil ist ein direktes Maß der Fluoreszenzlebensdauer. Grafik mit freundlicher Genehmigung des Houston Lab
Kürzlich belieferte Coherent die Houstoner Gruppe mit einem neuen OBIS-Modell, das für die Abgabe der Wellenlänge 349 nm entwickelt wurde. Dieser verwendet jedoch eine andere interne Technologie als die 375-nm-Laser und ist nicht so einfach direkt zu modulieren. Das war für die Gruppe jedoch kein Problem, denn vor einigen Jahren hatte diese eine durchdachte Technik namens nichtmodulierte Fluoreszenzlebensdauer-Zytometrie (nFLIC) entwickelt. Bei dieser wird zum Bestimmen der durchschnittlichen Fluoreszenzlebensdauer ein Dauerstrichlaser (CW) verwendet.
Abbildung 1 stellt die Funktionsweise dar. Wenn eine Zelle den Fokus passiert, steigt und fällt bei einem Laser mit perfekten TEM00-Ausgangsstrahl die Anregungswahrscheinlichkeit entlang des Gaußschen Strahlprofils. Aber die Abklingzeit der Fluoreszenz ungleich Null verursacht ein Phänomen, das Fluoreszenz-Pulsverzögerung (FPD) genannt wird. Beim Durchgang der Zelle durch den Strahl fällt die Fluoreszenzintensität langsamer ab als das Gaußsche Anregungsprofil. Und das Team um Dr. Houston hat präzise bewiesen, dass die FPD eine gültige Darstellung der durchschnittlichen Fluoreszenzlebensdauer der Zelle ist.
Der neue OBIS 375 hat sich aufgrund seiner überlegenen Ausgangsstrahlqualität im Labor von Dr. Houston sehr gut für nFLIC-Studien bewährt. Professor Houston erklärt: „Erstens liefert er genau die schöne, saubere TEM00-Strahlform, die wir brauchen. Er ist außerdem sehr rauscharm. Und ebenso wichtig: Leistung, Strahlform und Strahlausrichtung sind sehr stabil. Das ist wichtig, weil damit die Beziehung zwischen Fluoreszenzpulsabfall und Fluoreszenzlebensdauer mithilfe spezieller fluoreszierender Kügelchen zuverlässig kalibriert werden kann.“."
Resistenz gegen Krebszellen
Krebszellen sind ein ernstzunehmender Gegner, da sie häufig Resistenzen gegen ansonsten wirksame Chemotherapeutika entwickeln. Auf der CYTO 2023 Konferenz (Montreal, Kanada) bot Samantha Valentino – eine Doktorandin im Labor von Dr. Houston – eine hervorragende Präsentation, die den Wert der zeitaufgelösten Durchflusszytometrie zur Bestimmung von Fluoreszenzlebensdauer und Redoxverhältnissen von FAD/NADH als leistungsstarkes Werkzeug zeigte. Es wurde damit die Resistenz von Brustkrebs gegen das Chemotherapeutikum Tamoxifen überwacht.

Raten der Fluoreszenzlebensdauer bei Brustkrebszellen der Typen MCF und T47D – ein Vergleich zwischen empfänglichen und resistenten Zelllinien. Grafik mit freundlicher Genehmigung des Houston Lab
Insbesondere erklärte sie, dass Tamoxifen ein weit verbreitetes, gegen Brustkrebs wirksames Medikament mit positiver Östrogenrezeptor-Eigenschaft ist. Es wird verwendet, um Remissionen zu erreichen. Resistenzen entwickeln sich jedoch typischerweise innerhalb von 2 bis 5 Jahren nach Behandlungsbeginn. Valentino stellte zunächst fest, dass das Redoxverhältnis bei aggressiveren Krebszellen, wie etwa denen von arzneimittelresistenten Krebsarten, oft stärker verzerrt ist. Sie untersuchte zwei Brustkrebsarten (MCF-7 und T47D). In beiden Fällen verglich sie Krebszelllinien, die für Tamoxifen empfänglich waren, mit Zelllinien, die gegen Tamoxifen resistent waren. Abbildung 2 fasst die Ergebnisse zusammen. Sie zeigt, dass ihr Ansatz einen statistisch signifikanten Unterschied zwischen den empfänglichen und resistenten Zelltypen ergab. Es muss nicht ausdrücklich betont werden, dass die Fähigkeit, Krebszellpopulationen schnell auf ihre Resistenzeigenschaften gegen Arzneimittel zu analysieren, sich als wichtiges neues Instrument im Arsenal der Krebsbekämpfung erweisen kann: sowohl in der Wirkstoffentwicklung als auch in der Forschung sowie für die Bereitstellung verbesserter patientenspezifischer Behandlungen.
Zusammenfassung
Auf laserangeregter Fluoreszenz basierende Analysetechniken wie die Durchflusszytometrie, DNA-Sequenzierung und mikroskopische Gewebebiopsien sind zunehmend wichtigere Instrumente des Trends zu individuell ausgerichteten Behandlungsformen. Ein Trend, der durch die Covid-19-Pandemie noch beschleunigt wurde. Coherent setzt sich stark dafür ein, Fortschritte bei diesen Verfahren mit Laserwerkzeugen für verbesserte Geschwindigkeit und Datenqualität zu unterstützen, die Hürde für den Einsatz senken und die Gesamtkosten der Instrumentierung zu verringern.